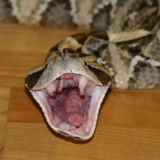
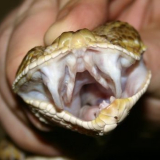
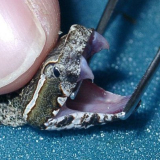
grüne Peitschennatter (BOIE 1827)
Am 30. März 2008 sind 1.1 Ahaetulla prasina's bei uns eingezogen. Vielen Dank an Christoph.
Mit freundlicher Genehmigung veröffentlichen wir den Haltungsbericht von Christoph Rotenbühler, da auch unsere Jungtiere Nachzuchten von ihm sind. Wir denken dass sein Nachzuchterfolg der grünen Peitschennatter einer vorbildlichen Haltung vorhergeht. Später werden wir den Bericht mit unseren Erfahrungen ergänzen.
1. Vorwort
1.1 Problematik
1.1.1 Wildfänge
Da es bis zum heutigen Tage keine gesicherten Nachzuchten dieser faszinierenden Tiere gibt, werden Jahr für Jahr tausende Tiere der Natur entnommen und zu Spotpreisen auf dem Markt verscherbelt, wo sie dann bei nicht artgerechter Haltung nach und nach eingehen. Die Tiere welche überleben, können pro Jahr an einer Hand abgezählt werden.
1.1.2 Echsenfresser
Ein weiteres Problem in der Haltung in Gefangenschaft ist der Speiseplan von A. prasina, auf welchem hauptsächlich Echsen und Frösche stehen. Selten werden auch kleine Vögel und andere Schlangen erbeutet. Nager so gut wie nie.
Da sich die meisten Schlangen von Mäusen und Ratten ernähren und dies in der Terraristik die gängigsten und am einfachsten zu beschaffenden Futtertiere sind, versuchen die meisten Halter von A. prasina die Umstellung auf eben diese Nager. Sei es aus Faulheit oder Ignoranz gegenüber den Tieren. Wieso soll ich mir eine gesicherte Geckoversorgung leisten, wenn ich das Tier auch auf Mäuse umstellen kann. Schliesslich lebt es (mit etwas Glück) auch so ca. 10 Jahre… Wenn man aber bedenkt, dass es ohne die Umstellung 20 bis 25 Jahre leben könnte, sollte den Mäuseanhängern langsam aber sicher ein Licht aufgehen.
1.1.3 Keine Kompromisse
Ich bin der Meinung, dass wenn man den Schritt wagt, diese wundervolle Schlange zu halten, dann ohne Mittelweg. Wenn sich jemand dazu entschliesst, sich einen Grünen Baumpython anzuschaffen, dessen Ruf ihm als extrem anspruchsvoller Pflegling vorauseilt, macht man auch keine Kompromisse. Man befolgt alle Parameter genauestens um das Tier nicht nach zwei Monaten zu verlieren. Und wieso? Weil man das teure Geld, dass man für eine stabile Nachzucht von M. viridis ausgegeben hat, nicht sinnlos verschwenden will.
Wieso also sollte man es bei A. prasina anders handhaben? Nur weil Wildfänge nicht zu solch hohen Preisen angeboten werden wie Nachzuchten? Ich sehe es genau Umgekehrt: Wenn man bedenkt, dass Wildfänge direkt aus der Natur stammen und die Schlange, welche nun zu Hause im eigenen Becken sitzt, in der Natur jetzt fehlt, sollte man sich doppelt so sehr anstrengen das eigene Wildfangexemplar zu erhalten!
1.2 Ziel
Dieser Bericht soll dazu dienen Erfahrungen dieser besonderen Schlange festzuhalten. Ziel ist es anhand dieses Berichtes herauszufinden, was nötig ist um A. prasina in Gefangenschaft nachziehen zu können. Ich hoffe mit diesen Anhaltspunkten futterfeste und stabile Nachzuchten schaffen und damit die Entnahme aus der Natur ein wenig vermindern zu können.
2. Kurzbeschrieb "Peppermint"
2.1 Wesen
Das Tier hat sich, soweit ich das beurteilen kann sehr schnell an die neue Umgebung gewöhnt. Ist sehr aufmerksam und verfolgt jede Bewegung vor dem Terrarium. Verharrt regungslos, wenn sie bemerkt, dass sie beobachtet wird. Nähert man sich ihr mit den Händen, nimmt sehr schnell die Drohposition ein und unternimmt Abwehrbisse, welche sehr genau ihr Ziel anvisieren und treffen.
Ansonsten sehr ruhig und gemächlich in ihren Bewegungen. Ob dies normal ist, kann ich nicht beurteilen, da diese Dame meine erste Schlange dieser Art ist.
2.2 Handling
Das Tier wird so wenig wie möglich gestört. Ich musste sie bis jetzt erst einmal zu Reinigungszwecken aus ihrem Terrarium nehmen. Nach zwei, drei Abwehrbissen kriegte ich sie zu fassen und zog sie langsam heraus. War das Tier einmal in den Händen, hat es keine weiteren Bissversuche unternommen und liess sich leicht transportieren.
3. Haltung
3.1 Terrarium
Ich halte meine 0.1 in einem Vollglasterrarium mit den Massen 120x60x100. Das Terrarium wurde mit reichlich Kletterästen, mitunter kleinste Zweige und Kunstpflanzen ausgestattet. Das Terrarium bietet reichlich Sichtschutz und somit Rückzugsmöglichkeiten für das Tier. Auch ein geübtes Auge braucht einen Augenblick um das Tier im dichten Geäst und den Rankpflanzen zu erkennen. Im ganzen Terrarium sind zwei Trinkgefässe im Geäst angebracht und zwar so, dass sie zum Reinigen mühelos herausgenommen und bei Bedarf auch ausgetauscht werden können.
3.2 Klima
Ich halte A. prasina bei Temperaturen von Tagsüber 26 bis 30 Grad bei einer relativen Luftfeuchtigkeit von 75 bis 80%. In der Nacht senke ich die Temperaturen auf 23 bis 25 Grad und die Luftfeuchtigkeit erhöht sich nach dem täglichen Sprühen am späten Nachmittag auf über 90%.
Die Grundtemperaturen von 25 bis 27 Grad erreiche ich durch eine Bodenheizung, welche einen Drittel des Bodens beheizt und über zwei Leuchtstoffröhren, welche direkt auf dem Glasbecken aufliegen. Beide sind mit einer Zeitschaltuhr gekoppelt und sind für 12 Stunden pro Tag eingeschaltet. Je nach Zimmertemperatur muss die Bodenheizung auch in der Nacht eingeschaltet sein, damit die Temperaturen nicht unter 22 Grad fallen.
Zusätzlich schaltet sich ein 40 Watt Spot, welcher mit einem Schutzkorb versehen ist, für ca. 4 Stunden über die Mittagszeit ein und sorgt lokal für Temperaturen zwischen 28 bis 30 Grad um die Mittagssonne zu simulieren.
3.3 Hilfsmittel
Wie erwähnt benötige ich für die Temperaturen eine Bodenheizung, zwei Leuchtstoffröhren, sowie ein 40 Watt Spot. Um die Luftfeuchtigkeit hoch zu halten, sprühe ich jeden zweiten (wenn nötig auch jeden) Abend mit einem herkömmlichen Drucksprüher aus dem Baumarkt. Ich sprühe die gesamte Einrichtung ab, damit die Tropfen, welche gebildet werden vom Tier aufgenommen werden können. Ich konnte bis jetzt weder eine Wasseraufnahme durch die Trinkgefässe, noch durch das “Ablecken“ beobachten. Die Luftfeuchtigkeit halte ich am Tag immer über 75%, in der Nacht erreiche ich dann meisten um die 80 bis 90%. Wichtig ist, dass nicht mit kaltem Wasser gesprüht wird, da das Tier beim Besprühen unweigerlich miteinbezogen wird und somit schnell auskühlen könnte. Ich verwende normales Leitungswasser, welches ich heiss abfülle. Somit ist das Wasser bis zum Versprühen lauwarm. Dank einem Rat eines deutschen Züchters, welcher A. prasina in Deutschland bereits erfolgreich nachgezogen hat, ist nach den Anfängen der Haltung in meinen Becken ein weiteres entscheidendes Hilfsmittel dazugekommen. Drei Lüfter, welche bei den oberen Lüftungsgitter angebracht sind, sorgen dafür, dass keine Stauluft entsteht. Man sollte einen Treibhauseffekt mit stehender Luft im oberen Viertel des Beckens weitestgehend vermeiden. Alle drei Lüfter schalten sich parallel zur Heizung und zu den Leuchtstoffröhren zu und gehen am Abend auch wieder mit den Letztgenannten aus. Die Lüfter laufen nur auf halber Drehzahl und sind zusammengeschaltet. Meiner Ansicht nach ist dies für eine leichte Luftzirkulation ausreichend.
3.4 Reinigung
Ich wechsle das Wasser in den Trinkgefässen täglich. Die Gefässe selbst, welche in den Ästen hängen, reinige ich nur einmal pro Woche. Bei extrem verschmutzten Gefässen z. B. durch Kot und Urin wird natürlich sofort gereinigt. Ich verwende dabei normalen Weissweinessig, welchen man auch z.B. für Salatsaucen benutzt. Lokale Verschmutzungen auf Ästen und Kunstpflanzen werden mit Haushaltpapier und Wasser entfernt. Der Bodengrund wird nur halbjährlich komplett ausgetauscht.
4. Ernährung
4.1 Vorbereitungen
Wie unter 1.1.3 bereits erwähnt, handelt es sich bei Ahaetulla prasina um einen Echsenfresser und ich halte nichts davon die Tiere auf Mäuse umzustellen. Allerdings denke ich auch, dass ab und zu eine Babymaus oder Babyratte als Abwechslung nicht schaden dürfte. Versucht habe ich es allerdings nie.
Aus meiner Sicht ist es also unumgänglich eine eigene kleine Gecko- und/oder Anoliszucht aufzubauen, oder zumindest eine gesicherte Bezugsquelle von Futterechsen zu haben. Ich für meinen Teil sorge selbst für das Futter, da ich somit auch sicher sein kann, dass ich keine Futterechsen verwende, welche zu tausende als Wildfänge importiert wurden. Wie bei meinen Schlangen, sorge ich so auch beim entsprechenden Futter dafür, dass nur gesunde Tiere verfüttert werden.
4.2 Futtertierarten
Ich habe mich nach reichlichen Abklärungen dazu entschlossen Zuchtgruppen von Anolis carolinensis (Rotkehlanolis), phelsuma madagascariensis grandis (grosser Madagascar Gecko), sowie Hemidactylus frenatus (Asiatischer Hausgecko) aufzubauen. Einerseits sind beide in ihrer Haltung ziemlich einfach und in verhältnismässig kleinen Becken unterzubringen, andererseits können sie in relativ grossen Gruppen von 1.4 gehalten werden. Beide sind ausgewachsen recht gross und doch nicht zu gross um ohne Probleme von adulten Tieren gefressen werden zu können. Juvenile Echsen eignen sich hervorragend für die Aufzucht von jungen A. prasina’s und werden ohne Probleme angenommen. Somit erübrigt sich auch der Kampf beim Stopfen mit Mäusen und die Gefahr junge Tiere dadurch zu verletzen oder zu verlieren.
Weiter erhalte ich immer wieder junge Physignathus Cocincinus (grüne Wasseragame) von befreundeten Züchtern. Diese Tiere weisen meist Fehler in der Wirbelsäule oder im Schwanz auf und können so nicht verkauft werden. Im Alter von 3 bis 4 Monaten erreichen Wasseragamen etwa die gleiche Grösse wie ausgewachsene grössere Anolis- oder Geckoarten. Zudem leben Wasseragamen auch in Südostasien und dürften zum natürlichen Beutespektrum von A. prasina gehören.
Ab und zu erhalte ich auch noch junge Zwergbartagamen. Diese Art verfüttere ich aber eher selten, da ich das Gefühl habe, dass die dornige Haut dieser Tiere mehr Verdauungsarbeit bei den Schlangen hervorruft. Dies ist aber nur ein subjektiver Eindruck meinerseits.
4.3 Fütterung von juvenilen Tieren
Diese Infos sind nun unter 5.4.2 Fütterung zu finden.
4.4 Fütterung von adulten Tieren
Meine Tiere erhalten jede Woche ein bis zwei Geckos, Anolis, Zwergbart- oder Wasseragamen. Immer im Abstand von vier bis sieben Tagen. Da die Echsen für die Tiere aus meiner Sicht keine Bedrohung darstellen, verfüttere ich ausnahmslos lebende Echsen. Ich habe auch noch nie versucht tote Echsen zu verfüttern. Ich setze die Echsen einfach in der Nähe der Tiere ab. Meistens sind die Echsen so aktiv, dass sie ohnehin innert ein paar Minuten von den Schlangen entdeckt werden. Ist die nicht der Fall, versuche ich die Echsen mit einem langen, dünnen Ast in die Richtung der Schlange zu “schubsen“. Zeigt das Tier kein Interesse am Futter oder ist zu aufgeregt und auf mich fixiert, lasse ich Beide einfach in Ruhe. Da die Echse keine Gefahr darstellt, lasse ich Futtertiere schon mal über einen längeren Zeitraum im Terrarium der Tiere. Passieren kann meiner Meinung nach nichts.
Nachtrag 02.06.2007
Seit zwei Monaten bin ich nun auch glücklicher Besitzer eines männlichen Gegenstücks dieser wunderschönen Art. Dieser Bock wurde bereits über mehrere Jahre im Terrarium gehalten und machte -laut Aussagen der vorherigen Halter- nie Probleme und soll von alleine an lebende, nackte Babyratten gehen. Am 26.05.2007 habe ich Dies das erste Mal versucht. Ich legte 3 Babyratten in einem kleinen Plastikbehälter in die Zweige und wartete ab. Tatsächlich machte sich das Männchen keine 10 Minuten später über die Ratten her.
Selbstverständlich frisst er genau so motiviert Futterechsen, welche auch dem Weib angeboten werden. Angst, dass ihn die Ratten nicht mehr interessieren könnten, habe ich nicht. Denn der Rattenmahlzeit gingen bereits 4 Echsenfütterungen voraus und trotzdem hat er die Ratten angenommen. Ich werde es so handhaben, dass ich alle 2-3 Wochen mal wieder Ratten anbieten werde. Die Hauptnahrung soll aber weiterhin aus Echsen bestehen.
5. Zucht
5.1 Paarung
Wie unter 4.4 erwähnt durfte ich meinen Bestand im März um einen adulten Bock erweitern. Da die Paarungszeit im Frühling liegt, habe ich das Tier nach parasitologischer Untersuchung nach kurzer Eingewöhnungszeit (am 06.04.2007)mit dem Weibchen zusammengesetzt. Bereits einen Tag später konnte ich erste Paarungsversuche beobachten. Das Männchen kriecht dabei langsam und züngelnd über den Körper des Weibchens und beginnt dann damit seinen letzten Körperdrittel wie eine Liane um den hinteren Körperteil des Weibchens zu wickeln. Während dieses Prozesses zuckt das Männchen mit dem ganzen Körper. Dies konnte ich vermehrt während des späteren Nachmittages bis zum Erlöschen der Lampen beobachten. Am Morgen waren die Tiere meistens wieder voneinander getrennt.
Ich kann aber nicht mit Bestimmtheit sagen, dass die Paarungsversuche, welche sich noch über weitere zwei Wochen hinzogen, zum Erfolg geführt haben. Ich kann aber mit Sicherheit sagen, dass sich das Weibchen in den letzten vier Wochen intensiver auf Nahrungssuche macht, als vor der Paarung. Ob dies aber wirklich mit einer möglichen Befruchtung oder nur mit dem Sommeranfang und den etwas veränderten Zeitzyklen zu tun hat, bleibt alleine dem Wissen der Tiere vorbehalten.
5.2 Erste Nachzuchten!
Es hat doch tatsächlich geklappt! Die Freude ist gross, durfte ich doch am 04.11.2007 feststellen, dass 7 vollentwickelte und top fitte Neugeborene durch das Becken der Eltern wuselten. Ich habe zwar immer gehofft, dass noch etwas kommen wird, allerdings hat man dem Weibchen nichts angesehen. Eventuell habe ich mich auch zuwenig intensiv um Beobachtungen bemüht. Ich konnte weder ein anderes Verhalten des Weibchens noch eine auffallende Zunahme des Körperumfangs feststellen. Was ich allerdings bemerkte war, dass das Weibchen in den letzten 4 Wochen keine Nahrung mehr zu sich genommen hatte. Da dies aber nicht weiter ungewöhnlich war, habe ich mir darüber keine weiteren Gedanken gemacht. Ich kann auch nicht mit Bestimmtheit sagen, dass die Tiere am 04. November zur Welt kamen, da ich dem Becken ca. 1½ Tage keine Beachtung geschenkt habe. Die Geburt, der im Durchschnitt ca. 55cm langen “Würmer“, muss also zwischen dem 03. und 04. November stattgefunden haben. Da ich die Geburt also nicht selbst miterlebt habe, besteht auch die Möglichkeit, dass es eigentlich noch mehr Tiere gewesen sein könnten. Bei meinem Männchen (wird mit dem Weibchen zusammen gehalten), welches auf jede Bewegung mit einem hungrigen Blick reagiert, besteht durchaus die Möglichkeit, das ein oder andere Junge verloren zu haben. Totgeburten gab es jedoch keine.
5.3 Die Neugeborenen
5.3.1 Erste Beobachtungen
Nachdem ich zuerst einmal eine Viertelstunde lang sprachlos und mit grossen Augen in das Becken gestarrt hatte, habe ich damit begonnen die Tiere in Zweiergruppen in -mit Haushaltpapier ausgelegten- Plastikbecken unterzubringen. Hier zeigten sich schon markante Charakterunterschiede; während sich die einen problemlos hantieren liessen, schnappten die anderen bei jeder noch so kleinen Gelegenheit nach meinen Fingern oder versuchten sich aus dem Staub zu machen. Gehäutet hatten sich die Tiere bis am 05. November übrigens noch nicht. Ich konnte jedenfalls keine Anzeichen oder Überreste einer ersten Häutung erkennen oder finden.
5.3.2 Beschreibung
Nach einer Tragezeit von ca. 7 Monaten kommen die Tiere lebend zur Welt. Im Gegensatz zu den adulten Tieren sind die juvenilen Tiere nicht grün, sondern braun. Die Färbung variiert von hell- bis dunkelbraun und färbt sich bei den meisten Tieren zur Unterseite hin ocker. Dies verstärkt die sowieso schon gute Tarnung im Geäst nochmals wesentlich. Die markanten schwarzen Seitenflecken, welche sich bei Erregung zeigen, sind jedoch von Geburt an vorhanden, stechen aber durch die braune Grundfärbung nicht so stark hervor wie bei der grünen Grundfärbung.
Die Tiere sind zwischen 48 und 62 cm lang und weisen an der dicksten Stelle einen Durchmesser zwischen 5 und 8 mm auf. Gewogen wurden die Tiere nicht.
Anhand der äusseren Erscheinung ist es mir nicht möglich die Geschlechter zu bestimmen. Ich werde abwarten und beobachten, ob sich die Unterschiede mit der Zeit zeigen werden.
5.4 Aufzucht
5.4.1 Allgemein
Ich habe mich dazu entschlossen die Tiere in Gruppen von 3 und 4 Tieren in zwei Terrarien (lxbxh 60x40x50) aufzuziehen. Beide Becken sind identisch eingerichtet. Als Bodengrund verwende ich Kokoshumus. Am Boden habe ich ein Trinkgefäss platziert. Ich rechne allerdings nicht damit, dass dieses viel benutzt wird. Ich konnte auch mein adultes Paar noch nie beim Trinken aus Wasserschalen beobachten, auch nicht aus denjenigen, welche in den Ästen platziert worden sind. Weiter wurden diverse Äste in verschiedenen Durchmessern verwendet, an denen ich mehrere Kunstpflanzen befestigt habe. Die Pflanzen bilden ein wirres Dickicht um den Tieren genügend Versteckmöglichkeiten bieten zu können. Ich halte die Tiere bei Tagestemperaturen von 25-27 Grad mit einer Nachtabsenkung bis auf 22 Grad. Die LF liegt tagsüber zwischen 80-90% und wird durch abendliches Sprühen in der Nacht erhöht. Ich sprühe die gesamte Einrichtung inklusive der Tiere am frühen Abend mit warmen Wasser an. Die Tiere trinken danach meistens direkt die sich bildenden Tropfen an den Scheiben oder der Einrichtung.
Die Temperatur wird mit einem Spot, welcher über dem Becken angebracht ist, erreicht.
Am 05.01.2008: Leider ist kurz vor der ersten Häutung ein Tier verendet. Eines Morgens lag es bereits tot auf dem Boden und hatte die gesamte Schnauze voller Humus. Ich konnte jedoch keine weiteren Anzeichen für das frühe Verenden des Tieres feststellen. Eingeschickt habe ich das Tier jedoch nicht.
5.4.2 Fütterung
Nach der ersten Häutung, welche sich bei den meisten Tieren nach 10-12 Tagen einstellt, habe ich die Tiere gefüttert. Ich hatte vor der Verfütterung von Echsen bewusst versucht die Tiere mit Fischen, Fröschen und frisch geborenen Babymäusen zu füttern. Alle potentiellen Beutetiere wurden konsequent ignoriert. Somit griff ich schlussendlich auf Echsen (kleine Anolis und Geckos) zurück und siehe da; es dauerte keine Minute bis die Futtertiere gepackt wurden.
In der Zwischenzeit erachte ich eine Echse in entsprechender Grösse einmal pro Woche als angemessen. Die Tiere scheinen sich prächtig zu entwickeln. Sie häuten sich regelmässig in einem Stück, trinken und fressen immer schön fleissig und erreichen nun (Stand 05.01.2008) mittlerweile eine Durchschnittslänge von ca. 70-75cm.