Geschlechtsbestimmungen
Hier möchte ich Euch mal aufzeigen, welche Möglichkeiten es für die Geschlechtsbestimmungen gibt. Leider kann man nicht jede Möglichkeit bei jeder Art / Unterart anwenden, das wäre ja viel zu einfach:-)
Die häufigsten Anwendungen für Pythons, Boas, Nattern, Giftnattern und Viperiden sind das Poppen und das Sondieren. Kommen wir zuerst einmal zum Poppen:
Beim Poppen geht es darum, mit einem Finger vom Schwanzende her Richtung Kloake durch Druck einen vorhandenen Hemipenis heraus zu Massieren.
Die Schlange verspürt dadurch keine Schmerzen und man kann eigentlich auch nicht verletzen. Natürlich macht man das mit Gefühl und nicht einfach mit roher Gewalt.
Ist ein Hemipenis vorhanden und gelingt es einem den heraus zu Massieren, so hat man zu 100% ein Männchen. Gelingt es nicht weil zum Beispiel das Tier noch zu jung ist oder schon älter und sich sperren kann, dann ist es eben nicht unbedingt ein Weibchen. Auch wenn man nur zwei rote Punkte neben der Kloake sieht sind das noch lange keine Hemipenis sondern eher Analdrüsen.
Wer jedoch geübt ist kann schon anhand der Weichheit oder Druckfestigkeit der Schwanzwurzel feststellen ob es ein Männchen oder ein Weibchen ist. Dank den Hemipenis-Taschen und den Hemipenise ist es bei den Männchen immer viel Weicher nach der Kloake als bei dem Weibchen.
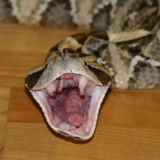
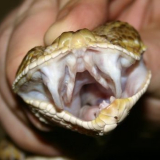
Ein Männchen von Pseudechis colletti, man beachte die Form nach der Kloake, sie wird nochmals etwas dicker.

Ein Weibchen von Pseudechis colletti, nach der Kloake geht es beim Weibchen schneller zusammen. Ich weis, man sieht den Unterschied etwas schlecht. Ich werde etwas später versuchen noch ein besseres Beispiel zu Dokumentieren.

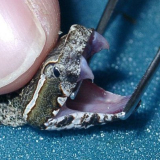
Ein Spermatropfen ergibt natürlich auch zu 100% ein Männchen.

ein ausgestülpter Hemipenis


Beim Sondieren geht es darum, die Tiefe zu ermitteln wo man mit einem Sondierstab bei der Kloake Richtung Schwanzende hineindringen kann. Beim Männchen geht der Sondierstab in den Hemipenistaschen immer weiter hinein als bei den Weibchen in die Klitoristasche. Doch Vorsichtig, braucht man bei einem Weibchen zu viel Gewalt kann man schnell auch die Klitoristasche durchstossen und das Gefühl bekommen, es sei ein Männchen.
Sondierstab immer Desinfizieren und zum Beispiel mit Vaseline einreiben. Vorsichtig unter Drehbewegung in die seitliche Tasche einführen. Geht es nicht mehr weiter dann den Sondierstab herausziehen und über den Schwanz legen und die Subcaudalia (Schwanzschuppen) zählen. Natürlich braucht es Vergleichsmöglichkeiten oder man hat anhand einer Literatur die Angaben der Schuppenzahlen vom Weibchen und Männchen einer Art, wie tief man eindringen kann.


Hat man anhand Literatur Angaben über die Anzahl der Subcaudalia's von Männchen und Weibchen einer Art, dann kann man natürlich auch einfach mal die Subcaudalia's zählen. Wenn es zwischen Männchen und Weibchen überschneidungen in der Anzahl gibt, dann hat man Pech. Hat man jedoch ein Exemplar welches mit der Anzahl Subcaudalia am unteren oder oberen liegt, dann hat man Glück.

Bei einigen Arten kann man nur schon Optisch sehen ob es sich um ein Männchen oder ein Weibchen handelt. Leider sind es nur wenige Arten bei denen es so einfach ist. Dazu gehört zum Beispiel die Puffotter Bitis arietans oder auch die Gabunviper Bitis rhinoceros. Die Weibchen haben einen extrem viel kürzeren Schwanz und auch die Form gleich nach der Kloake, es geht abrubt zusammen und nicht wie beim Männchen, wo es nach der Klake langsam zum Schwanzende gleichmässig verläuft.
Hier das Schwanzende eines Weibchens der Puffotter, Bitis arietans. Durch den extrem viel kürzeren Schwanz sind natürlich auch die Anzahl der Subcaudalia viel weniger.

Hier ein Männchen der Puffotter, Bitis arietans. Das Zählen der Subcaudalia erübrigt sich.

Hier bei Bitis rhinoceros sieht man schon gleich nach der Geburt die Unterschiede der Schwanzformen zwischen Männchen und Weibchen.

Eine weitere Möglichkeit ist der Geschlechtsdimorphismus, der leider selten bei Babys geht sondern erst bei adulten Tieren sichtbar wird.
Geschlechtsdimorphismus nennt man die Unterschiede im Erscheinungsbild von männlichen und weiblichen Individuen der gleichen Art, die sich nicht auf die Geschlechtsorgane selbst beziehen. Dieser Sexualdimorphismus kann sich in verschiedenen Körpermerkmalen darstellen. Zum Beispiel gibt es Arten wo die Männchen viel kleiner bleiben als die Weibchen. Dazu gehören Bothriechis schlegelii, Atheris squamigera oder auch Trimeresurus trigonocephalus. Wer ein sehr gut geübtes Auge hat kann schon die Geschlechter gleich nach der Geburt sehen, weil die Männchen einen schlankere Kopfform haben als die Weibchen. Doch bei Adulten Tieren sieht man den Unterschied in der Grösse sehr gut.
Hier im Bild Bothriechis schlegelii, das massige gelbe Tier mit dem grossen Kopf ist das Weibchen, das schlankere Tier mit dem kleineren Kopf ist das Männchen. Achtung, die Männchen können jedoch auch so lange werden wie die Weibchen, nur sind sie viel Schlanker.

Eine weitere Möglichkeit die es bei einigen Arten gibt nennst sich Geschlechtsdichromatismus.
Geschlechtsdichromatismus nennt man die unterschiedliche Färbung bei Männchen und Weibchen der selben Art. Bei Vögel kennt man das viel mehr da die Weibchen meist nicht so Bunt sind wie die Männchen.
Bei einigen Arten sind die Männchen und Weibchen schon von Geburt an unterschiedlich gefärbt wie zum Beispiel bei Botrops venezuelensis, Trimeresurus puniceus oder Trimeresurus trigonocephalus.
Hier ein männliches Baby von Bothrops venezuelensis, der rötlichen Form.

Hier ein wibliches Baby von Bothrops venezuelensis der roten Form. Bei der grünen Form ist der Geschlechtsdichromatismus genau gleich stark ausgeprägt. Die Männchen sind erheblich Kontrastreicher und Intensiver gefärbt.

Hier ein Männchen von Trimeresurus puniceus und

hier das Weibchen er selben Art. Auch wenn sie Adult sind verliert sich der Unterschied nicht.

Hier sieht man Babys der Trimeresurus trigonocephalus, Ceylon- Lanzenotter frisch auf der Welt. Die hellgrünen Tiere sind Weibchen und die bläulich gefärbten Tiere sind die Männchen.

Es gibt jedoch auch die Variante, dass beide Geschlechter gleich aussehend auf die Welt kommen und sich erst im Alter farblich verändern so dass es wieder einen Geschlechtsdichromatismus gibt. Ein gutes Beispiel ist Toxicodryas blandingii
So gefärbt kommen die Babys auf die Welt:

Doch nach ca. einem Jahr beginnen sie sich umzufärben. Die Männchen werden samtschwarz

und die Weibchen hellbraun mit dunkelbraunen Sattelflecken

Ihr sehr, Schlangen sind sehr vielseitig und es gibt so viele interessante Arten und Varianten, wir können das ganze Leben für die Schlangen Opfern und lernen nie aus. Gibt es ein schöneres Hobby? :-)